Inhaltsverzeichnis für diesen Artikel:
1. Entwicklung von Aminosäuren
2. Struktureigenschaften
3. Chemische Zusammensetzung
4. Klassifizierung
5. Synthese
6. Physikochemische Eigenschaften
7. Toxizität
8. Antimikrobielle Aktivität
9. Rheologische Eigenschaften
10. Anwendungen in der Kosmetikindustrie
11. Anwendungen in alltäglichen Kosmetika
Aminosäure -Tenside (AAS)sind eine Klasse von Tensiden, die gebildet werden, indem hydrophobe Gruppen mit einer oder mehreren Aminosäuren kombiniert werden. In diesem Fall können die Aminosäuren synthetisch oder aus Proteinhydrolysaten oder ähnlichen erneuerbaren Quellen abgeleitet werden. Dieses Papier deckt die Details der meisten verfügbaren synthetischen Routen für AAs und die Auswirkung verschiedener Routen auf die physikalisch -chemischen Eigenschaften der Endprodukte, einschließlich Löslichkeit, Dispersionsstabilität, Toxizität und biologischer Abbaubarkeit, ab. Als eine Klasse von Tensiden in steigender Nachfrage bietet die Vielseitigkeit von AAs aufgrund ihrer variablen Struktur eine große Anzahl von kommerziellen Möglichkeiten.
Angesichts der Tatsache, dass Tenside in Waschmitteln, Emulgatoren, Korrosionsinhibitoren, Tertiärölgewinnung und Pharmazeutika weit verbreitet sind, haben Forscher nie aufgehört, Tensiden zu achten.
Tenside sind die repräsentativsten chemischen Produkte, die weltweit täglich in großen Mengen konsumiert werden und sich negativ auf die aquatische Umgebung auswirken.Studien haben gezeigt, dass die weit verbreitete Verwendung traditioneller Tenside sich negativ auf die Umwelt auswirken kann.
Heutzutage sind Nicht-Toxizität, biologische Abbaubarkeit und Biokompatibilität für die Verbraucher fast genauso wichtig wie der Nutzen und die Leistung von Tensiden.
Biotenside sind umweltfreundliche nachhaltige Tenside, die natürlich von Mikroorganismen wie Bakterien, Pilzen und Hefen oder extrazellulärem sekretiertem sekretiertem Synthese synthetisiert werden.Daher können Biotenside auch durch molekulares Design hergestellt werden, um natürliche amphiphile Strukturen wie Phospholipide, Alkylglykoside und Acylaminosäuren nachzuahmen.
Aminosäure -Tenside (AAS)sind einer der typischen Tenside, die normalerweise aus tierischen oder landwirtschaftlich abgeleiteten Rohstoffen hergestellt werden. In den letzten zwei Jahrzehnten haben AAs von Wissenschaftlern als neuartige Tenside großes Interesse geweckt, nicht nur, weil sie aus erneuerbaren Ressourcen synthetisiert werden können, sondern auch, weil AAs leicht abbaubar sind und harmlose Nebenprodukte haben, was sie für die Umwelt sicherer macht.
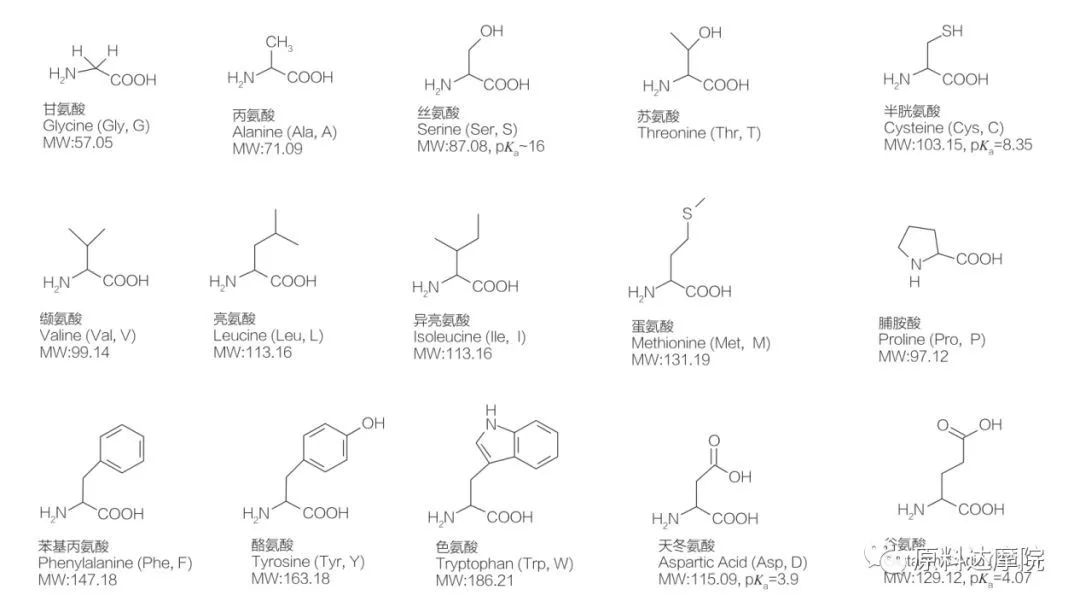
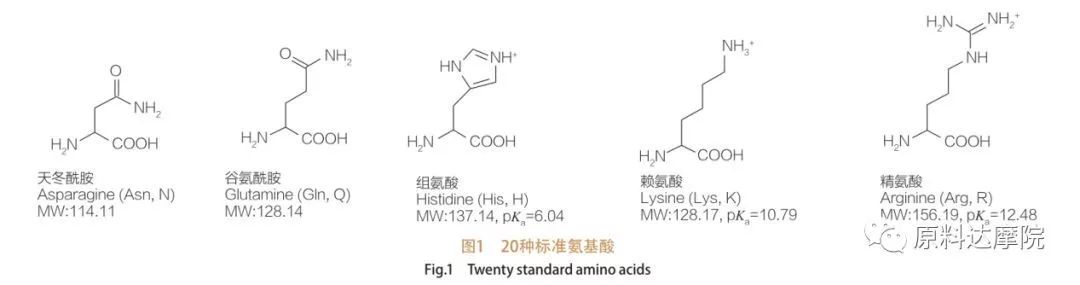
AAs können als eine Klasse von Tensiden definiert werden, die aus Aminosäuren bestehen, die Aminosäuregruppen (HO 2 c-chr-nh 2) oder Aminosäurereste (HO 2 C-chr-NH-) enthalten. Die 2 funktionellen Regionen von Aminosäuren ermöglichen die Ableitung einer Vielzahl von Tensiden. Es ist bekannt, dass in der Natur insgesamt 20 proteinogene Aminosäuren aus Standard -Aminosäuren vorhanden sind und für alle physiologischen Reaktionen in Bezug auf Wachstums- und Lebensaktivitäten verantwortlich sind. Sie unterscheiden sich nur nach dem Rest R (Abbildung 1, Pk A ist der negative Logarithmus der Säure -Dissoziationskonstante der Lösung). Einige sind nicht-polar und hydrophob, einige sind polar und hydrophil, einige sind grundlegend und andere saur.
Da Aminosäuren erneuerbare Verbindungen sind, haben Tenside, die aus Aminosäuren synthetisiert wurden, auch ein hohes Potenzial, nachhaltig und umweltfreundlich zu werden. Die einfache und natürliche Struktur, geringe Toxizität und schnelle biologische Abbaubarkeit machen sie häufig den konventionellen Tensiden überlegen. Mithilfe erneuerbarer Rohstoffe (z. B. Aminosäuren und pflanzliche Öle) können AAs durch verschiedene biotechnologische Routen und chemische Routen erzeugt werden.
Im frühen 20. Jahrhundert wurde zuerst festgestellt, dass Aminosäuren als Substrate für die Synthese von Tensiden verwendet wurden.AAs wurden hauptsächlich als Konservierungsmittel in pharmazeutischen und kosmetischen Formulierungen verwendet.Darüber hinaus wurde festgestellt, dass AAS gegen eine Vielzahl von krankheitsverursachenden Bakterien, Tumoren und Viren biologisch aktiv ist. Im Jahr 1988 generierte die Verfügbarkeit von kostengünstigen AAs Forschungsinteresse an der Oberflächenaktivität. Mit der Entwicklung der Biotechnologie können einige Aminosäuren heute auch in großem Maßstab von Hefe kommerziell synthetisiert werden, was indirekt beweist, dass die AAS -Produktion umweltfreundlicher ist.
01 Entwicklung von Aminosäuren
Bereits im frühen 19. Jahrhundert, als natürlich vorkommende Aminosäuren erstmals entdeckt wurden, wurden ihre Strukturen als äußerst wertvoll erwartet - nutzbar als Rohstoffe für die Herstellung von Amphiphilen. Die erste Studie zur Synthese von AAS wurde 1909 von Bondi berichtet.
In dieser Studie wurden N-Acylglycin und N-Acylalanin als hydrophile Gruppen für Tenside eingeführt. Nachfolgenden Arbeiten umfassten die Synthese von Lipoaminosäuren (AAS) unter Verwendung von Glycin und Alanin und Hentrich et al. veröffentlichte eine Reihe von Erkenntnissen,einschließlich der ersten Patentanwendung, bei der Verwendung von Acylsarkosinat- und Acyl -Aspartatsalzen als Tenside in Haushaltsreinigungsprodukten (z. B. Shampoos, Waschmittel und Zahnpasten).Anschließend untersuchten viele Forscher die Synthese und die physikalisch -chemischen Eigenschaften von Acylaminosäuren. Bisher wurde eine große Anzahl von Literatur in der Synthese, Eigenschaften, industriellen Anwendungen und der biologischen Abbaubarkeit von AAS veröffentlicht.
02 Struktureigenschaften
Die nicht-polaren hydrophoben Fettsäureketten von AAS können in Struktur, Kettenlänge und Anzahl variieren.Die strukturelle Vielfalt und die hohe Oberflächenaktivität von AAS erklären ihre breite Zusammensetzung und physikochemische und biologische Eigenschaften. Die Kopfgruppen von AAs bestehen aus Aminosäuren oder Peptiden. Die Unterschiede in den Kopfgruppen bestimmen die Adsorption, Aggregation und biologische Aktivität dieser Tenside. Die funktionellen Gruppen in der Kopfgruppe bestimmen dann die Art der AAS, einschließlich kationisch, anionisch, nichtionisch und amphoterer. Die Kombination von hydrophilen Aminosäuren und hydrophoben langkettigen Portionen bildet eine amphiphile Struktur, die das Molekül hochoberflächen wirkt. Darüber hinaus hilft das Vorhandensein von asymmetrischen Kohlenstoffatomen im Molekül dazu, chirale Moleküle zu bilden.
03 Chemische Zusammensetzung
Alle Peptide und Polypeptide sind die Polymerisationsprodukte dieser fast 20 α-Proteinogenen α-Aminosäuren. Alle 20 α-Aminosäuren enthalten eine Carboxylsäure-funktionelle Gruppe (-COOH) und eine Amino-funktionelle Gruppe (-nh 2), die beide an das gleiche tetraedrische α-Kohlenstoff-Atom gebunden sind. Aminosäuren unterscheiden sich von den verschiedenen R-Gruppen, die am α-Kohlenstoff gebunden sind (mit Ausnahme von Lycin, wo die R-Gruppe Wasserstoff ist). Die R-Gruppen können sich in Struktur, Größe und Ladung unterscheiden (Säure, Alkalinität). Diese Unterschiede bestimmen auch die Löslichkeit von Aminosäuren in Wasser.
Aminosäuren sind chiral (mit Ausnahme von Glycin) und von Natur aus optisch aktiv, da sie vier verschiedene Substituenten haben, die mit dem Alpha -Kohlenstoff verbunden sind. Aminosäuren haben zwei mögliche Konformationen; Sie sind nicht überlappende Spiegelbilder voneinander, obwohl die Anzahl der L-Stereoisomere signifikant höher ist. Die in einigen Aminosäuren vorhandene R-Gruppe (Phenylalanin, Tyrosin und Tryptophan) ist Aryl, was zu einer maximalen UV-Absorption bei 280 nm führt. Das saure α-Cooh und die Basis-α-NH 2 in Aminosäuren können Ionisation in der Lage sind, und beide Stereoisomere, je nachdem, was sie sind, konstruieren das unten gezeigte Ionisationsgleichgewicht.
R-cooh ↔r-coo-+ h+
R-nh3+↔r-nh2+ h+
Wie im obigen Ionisationsgleichgewicht gezeigt, enthalten Aminosäuren mindestens zwei schwach saure Gruppen; Die Carboxylgruppe ist jedoch im Vergleich zur protonierten Amino -Gruppe viel saurer. PH 7,4, die Carboxylgruppe ist deprotoniert, während die Amino -Gruppe protoniert ist. Aminosäuren mit nichtionisierbaren R-Gruppen sind bei diesem pH-Wert elektrisch neutral und bilden Zwitterion.
04 Klassifizierung
AAs können nach vier Kriterien klassifiziert werden, die nachstehend nacheinander beschrieben werden.
4.1 nach dem Ursprung
| Nach dem Ursprung können AAs wie folgt in zwei Kategorien unterteilt werden. ① Natürliche Kategorie Einige natürlich vorkommende Verbindungen, die Aminosäuren enthalten, haben auch die Fähigkeit, die Oberflächen-/Grenzflächenspannung zu reduzieren, und andere überschreiten sogar die Wirksamkeit von Glykolipiden. Diese AAs sind auch als Lipopeptide bekannt. Lipopeptide sind Verbindungen mit niedrigem Molekulargewicht, die normalerweise von Bacillus -Spezies produziert werden.
Solche AAs werden weiter in 3 Unterklassen unterteilt:Surfactin, Iturin und Fengycin.
|
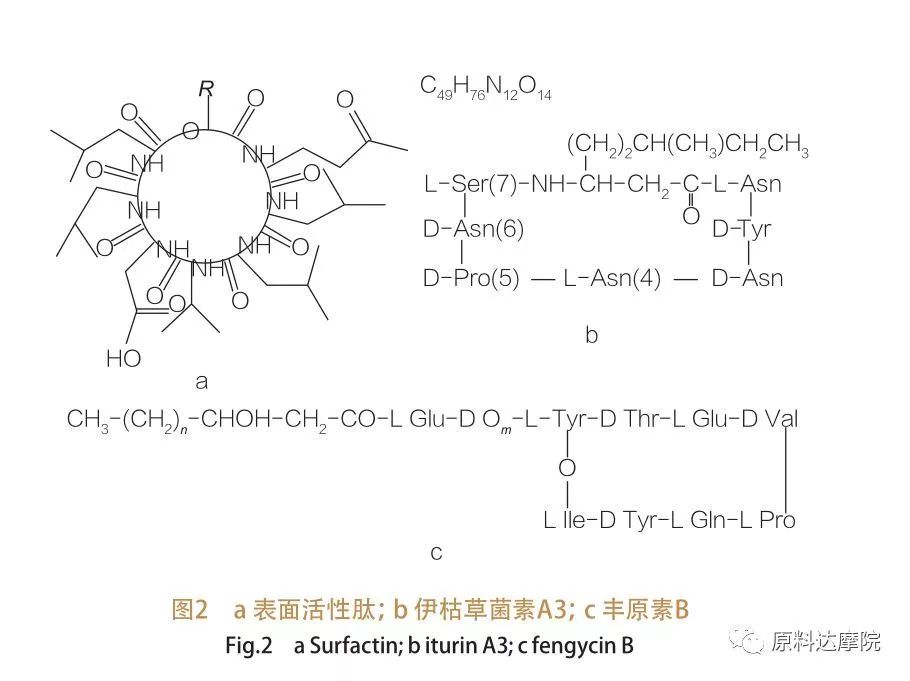
| Die Familie der oberflächenaktiven Peptide umfasst Heptapeptidvarianten einer Vielzahl von Substanzen,wie in 2A gezeigt, in dem eine c12-C16-ungesättigte β-Hydroxy-Fettsäurekette mit dem Peptid verbunden ist. Das oberflächenaktive Peptid ist ein makrocyclischer Lacton, bei dem der Ring durch Katalyse zwischen dem C-Terminus der β-Hydroxyfettsäure und des Peptids geschlossen wird. In der Unterklasse von Iturin gibt es sechs Hauptvarianten, nämlich Iturin A und C, Mycosubtilin und Bacillomycin D, F und L.In allen Fällen sind die Heptapeptide mit den C14-C17-Ketten von β-Amino-Fettsäuren verbunden (die Ketten können vielfältig sein). Im Fall der Ekurimycine kann die Amino-Gruppe in der β-Position eine Amidbindung zum C-Terminus bilden, der eine makrocyclische Lactam-Struktur bildet.
Die Unterklasse Fengycin enthält Fengycin A und B, die auch als Pipastatin bezeichnet werden, wenn Tyr9 d-konfiguriert ist.Das Dekapeptid ist mit einer gesättigten oder ungesättigten β -Hydroxy -Fettsäurekette von C14 -C18 verbunden. Strukturell ist Plipastatin auch ein makrocyclischer Lacton, das eine Tyr-Seitenkette an Position 3 der Peptidsequenz enthält und eine Esterbindung mit den C-terminalen Resten bildet, wodurch eine interne Ringstruktur bildet (wie für viele Pseudomonas Lipopeptide).
② Synthetische Kategorie AAs können auch unter Verwendung einer der sauren, basischen und neutralen Aminosäuren synthetisiert werden. Häufige Aminosäuren, die für die Synthese von AAS verwendet werden, sind Glutaminsäure, Serin, Prolin, Aspartinsäure, Glycin, Arginin, Alanin, Leucin und Proteinhydrolysate. Diese Unterklasse von Tensiden kann durch chemische, enzymatische und chemoenzymatische Methoden hergestellt werden; Für die Produktion von AAS ist die chemische Synthese jedoch wirtschaftlicher. Häufige Beispiele sind N-Lauroyl-L-Glutaminsäure und N-Palmitoyl-L-Glutaminsäure.
|
4.2 Basierend auf aliphatischen Substituenten der Kettenkette
Basierend auf den aliphatischen Kettensubstituenten können Tenside auf Aminosäurerbasis in 2 Typen unterteilt werden.
Gemäß der Position des Substituenten
| ①N-substituierte aas In n-substituierten Verbindungen wird eine Aminogruppe durch eine lipophile Gruppe oder eine Carboxylgruppe ersetzt, was zu einem Verlust der Basizität führt. Das einfachste Beispiel für n-substituierte AAS sind N-Acyl-Aminosäuren, die im Wesentlichen anionische Tenside sind. N-substituierte AAs haben eine Amidbindung, die zwischen den hydrophoben und hydrophilen Teilen gebunden ist. Die Amidbindung kann eine Wasserstoffbindung bilden, die den Abbau dieses Tensids in einer sauren Umgebung erleichtert und so biologisch abbaubar macht.
②C-substituierte AAS In C-substituierten Verbindungen tritt die Substitution in der Carboxylgruppe (über eine Amid- oder Esterbindung) auf. Typische C-substituierte Verbindungen (z. B. Ester oder Amide) sind im Wesentlichen kationische Tenside.
③n- und c-substituierte AAS Bei dieser Art von Tensid sind sowohl die Amino- als auch die Carboxylgruppen der hydrophile Teil. Dieser Typ ist im Wesentlichen ein amphoteres Tensid. |
4.3 gemäß der Anzahl der hydrophoben Schwänze
Basierend auf der Anzahl der Kopfgruppen und hydrophoben Schwänze können AAs in vier Gruppen unterteilt werden. AAS-AAS, AAS-AAS (Dimer) AAS, AAS-Typ AAS, AAS mit Glycerolipid und bizphale Amphiphil (BOLA) AAS. Tenside sind geradekettige Tenside, die aus Aminosäuren mit nur einem hydrophoben Schwanz bestehen (Abbildung 3). Gemini -Typ AAs haben zwei Aminosäurepolare Kopfgruppen und zwei hydrophobe Schwänze pro Molekül (Abbildung 4). In dieser Art von Struktur werden die beiden geraden Ketten-AAs durch einen Abstandshalter miteinander verbunden und werden daher auch Dimere bezeichnet. In den AAS -AAS -Glycerolipiden hingegen sind die beiden hydrophoben Schwänze an derselben Aminosäurer -Kopfgruppe befestigt. Diese Tenside können als Analoga von Monoglyceriden, Diglyceriden und Phospholipiden betrachtet werden, während in AAS-AAS-Typen im Bola-Typ zwei Aminosäurerkopfgruppen durch einen hydrophoben Schwanz verbunden sind.
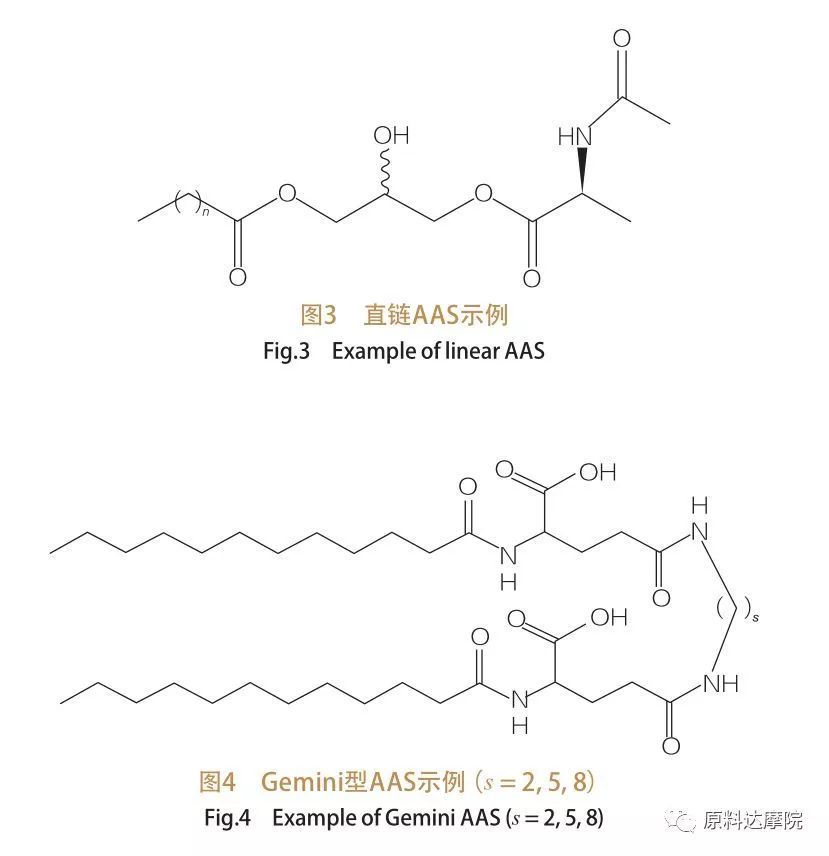
4.4 gemäß der Art der Kopfgruppe
①Cationic aas
Die Kopfgruppe dieser Art von Tensid hat eine positive Ladung. Das früheste kationische AAS ist Ethylcocoyl -Arginat, ein Pyrrolidon -Carboxylat. Die einzigartigen und vielfältigen Eigenschaften dieses Tensids machen es in Desinfektionsmitteln, antimikrobiellen Wirkstoffen, antistatischen Wirkstoffen, Haarzuständen und sanft auf Augen und Haut und leicht biologisch abbaubar. Singare und Mhatre synthetisierten kationische AAs auf Argininbasis und bewerteten ihre physikalisch-chemischen Eigenschaften. In dieser Studie behaupteten sie hohe Ausbeuten der Produkte, die unter Verwendung von Schotten-Baumann-Reaktionsbedingungen erhalten wurden. Mit zunehmender Alkylkettenlänge und Hydrophobizität wurde festgestellt, dass die Oberflächenaktivität des Tensids zunimmt und die kritische Mizellenkonzentration (CMC) abnimmt. Ein anderes ist das quaternäre Acylprotein, das üblicherweise als Conditioner in Haarpflegeprodukten verwendet wird.
②anionische AAS
Bei anionischen Tensiden hat die polare Kopfgruppe des Tensids eine negative Ladung. Sarkosin (CH 3 -NH -CH 2 -COOH, N -methylglycin), eine Aminosäure, die häufig in Seeigel und Seestern vorkommt, ist chemisch mit Glycin (NH 2 -CH 2 -COOH) verwandt, eine grundlegende Aminosäure, die in Säugetierzellen gefunden wurde. -COOH,) ist chemisch mit Glycin verwandt, einer grundlegenden Aminosäure, die in Säugetierzellen vorkommt. Laurinsäure, Tetradenkansäure, Ölsäure und ihre Halogenide und Ester werden üblicherweise zur Synthese von Sarkosinattensiden verwendet. Sarkosinate sind von Natur aus mild und werden daher üblicherweise in Mundwaschen, Shampoos, Sprühschaum, Sonnenschutzmitteln, Hautreinigern und anderen kosmetischen Produkten verwendet.
Andere im Handel erhältliche anionische AAS sind Amisoft CS-22 und Amilitegck-12, die Handelsnamen für Natrium-N-Cocoyl-L-Glutamat bzw. Kalium-N-Kooylglycinat sind. Amilit wird üblicherweise als Schaummittel, Waschmittel, Solubilizer, Emulgator und Dispergiermittel verwendet und hat viele Anwendungen in Kosmetika, wie Shampoos, Badseifen, Körperwaschungen, Zahnpasten, Gesichtsreiniger, Reinigungsseifen, Kontaktlinsenreiniger und Haushaltshalterungen. Amisoft wird als milder Haut- und Haarreiniger verwendet, hauptsächlich in Gesichts- und Körperreinigern, blockieren synthetische Waschmittel, Körperpflegeprodukte, Shampoos und andere Hautpflegeprodukte.
③Zwitterionic oder amphotere AAS
Amphoterische Tenside enthalten sowohl saure als auch grundlegende Stellen und können daher ihre Ladung ändern, indem sie den pH -Wert ändern. In alkalischen Medien verhalten sie sich wie anionische Tenside, während sie sich in sauren Umgebungen wie kationische Tenside und in neutralen Medien wie amphoterische Tenside verhalten. Lauryl Lysin (LL) und Alkoxy (2-Hydroxypropyl) Arginin sind die einzigen bekannten amphoterischen Tenside, die auf Aminosäuren basieren. LL ist ein Kondensationsprodukt von Lysin und Laurinsäure. Aufgrund seiner amphoteren Struktur ist LL in fast allen Arten von Lösungsmitteln unlöslich, mit Ausnahme sehr alkalischer oder saurer Lösungsmittel. Als organisches Pulver hat LL eine hervorragende Haftung an hydrophilen Oberflächen und einen geringen Reibungskoeffizienten, was diesem Tensid die hervorragende Schmierfähigkeit verleiht. LL wird häufig in Hautcremes und Haarkonditionierern verwendet und auch als Schmiermittel verwendet.
④Nonionic aas
Nichtionische Tenside sind durch polare Kopfgruppen ohne formelle Anklage gekennzeichnet. Acht neue ethoxylierte nichtionische Tenside wurden von Al-Sabagh et al. aus öllöslichen α-Aminosäuren. In diesem Prozess wurden L-Phenylalanin (LEP) und L-Leucin zuerst mit Hexadecanol verärgert, gefolgt von Amidierung mit Palmitinsäure, um zwei Amide und zwei Ester von α-Aminosäuren zu ergeben. Die Amide und Ester wurden dann Kondensationsreaktionen mit Ethylenoxid unterzogen, um drei Phenylalanin -Derivate mit unterschiedlicher Anzahl von Polyoxyethyleneinheiten (40, 60 und 100) herzustellen. Bei diesen nichtionischen AAS wurde festgestellt, dass sie gute Wasch- und Schaumeigenschaften haben.
05 Synthese
5.1 grundlegende synthetische Route
In AAS können hydrophobe Gruppen an Amin- oder Carboxsäurestellen oder durch die Seitenketten von Aminosäuren befestigt werden. Basierend darauf sind vier grundlegende synthetische Routen verfügbar, wie in Abbildung 5 dargestellt.
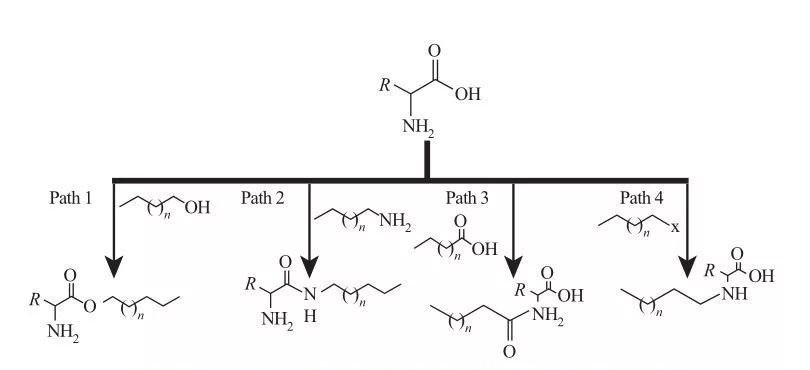
Abb.5 Grundlegende Synthesewege von Tensiden auf Aminosäurerbasis
| Weg 1. Amphiphile Esteramine werden durch Veresterungsreaktionen erzeugt. In diesem Fall wird die Tensidsynthese normalerweise durch Rückfluss von Fettalkoholen und Aminosäuren in Gegenwart eines Dehydratisierungsmittels und eines sauren Katalysators erreicht. Bei einigen Reaktionen wirkt Schwefelsäure sowohl als Katalysator als auch als dehydrierender Mittel.
Weg 2. Aktivierte Aminosäuren reagieren mit Alkylaminen, um Amidbindungen zu bilden, was zur Synthese von Amphiphilmaminen führt.
Weg 3. Amidosäuren werden durch Reaktion der Amingruppen von Aminosäuren mit Amidsäuren synthetisiert.
Weg 4. Langkettige Alkylaminosäuren wurden durch die Reaktion von Amingruppen mit Haloalkanen synthetisiert. |
5.2 Fortschritte in der Synthese und Produktion
5.2.1 Synthese von Einzelketten-Aminosäure/Peptid-Tensiden
N-Acyl- oder Oacylaminosäuren oder Peptide können durch enzymkatalysierte Acylierung von Amin- oder Hydroxylgruppen mit Fettsäuren synthetisiert werden. Der früheste Bericht über die lösungsmittelfreie Lipase-katalysierte Synthese von Aminosäureamid- oder Methylester Derivaten verwendete Candida Antarctica mit Ausbeuten von 25% bis 90%, abhängig von der Zielaminosäure. Methylethylketon wurde auch als Lösungsmittel bei einigen Reaktionen verwendet. Vonderhagen et al. beschrieben auch Lipase- und Protease-katalysierte N-Acylierungsreaktionen von Aminosäuren, Proteinhydrolyaten und/oder deren Derivaten unter Verwendung eines Gemisches aus Wasser und organischen Lösungsmitteln (z. B. Dimethylformamid/Wasser) und Methylbutylketon.
In den frühen Tagen war das Hauptproblem bei der enzymkatalysierten Synthese von AAS die niedrigen Ausbeuten. Nach Valivety et al. Die Ausbeute von N-Tetradecanoyl-Aminosäure-Derivaten betrug auch nach der Verwendung verschiedener Lipasen und inkubieren für viele Tage bei 70 ° C nur 2% bis 10%. Montet et al. Auch auf Probleme mit der geringen Ausbeute von Aminosäuren bei der Synthese von N-Acyl-Lysin unter Verwendung von Fettsäuren und pflanzlichen Ölen stoßen. Nach Ansicht der maximalen Ausbeute des Produkts betrug 19% unter lösungsmittelfreien Bedingungen und organische Lösungsmittel. Das gleiche Problem wurde von Valivety et al. In der Synthese von N-CBZ-L-Lysin oder N-CBZ-Lysin-Methylester-Derivaten.
In dieser Studie behaupteten sie, dass der Ertrag von 3-O-Tetredecanoyl-L-Serin 80% bei der Verwendung von N-geschütztem Serin als Substrat und Novozym 435 als Katalysator in einer geschmolzenen, lösungsmittelfreien Umgebung betrug. Nagao and Kito studied the O-acylation of L-serine, L-homoserine, L-threonine and L-tyrosine (LET) when using lipase The results of the reaction (lipase was obtained by Candida cylindracea and Rhizopus delemar in aqueous buffer medium) and reported that the yields of acylation of L-homoserine and L-serine were somewhat low, while no Acylierung von L-Threonin und aufgetreten.
Viele Forscher haben die Verwendung kostengünstiger und leicht verfügbarer Substrate für die Synthese von kostengünstigen AAS unterstützt. Soo et al. behauptete, dass die Herstellung von Tensiden auf Palmölbasis am besten mit immobilisiertem Lipoenzym zusammenarbeitet. Sie stellten fest, dass die Ausbeute der Produkte trotz der zeitaufwändigen Reaktion (6 Tage) besser wäre. Gerova et al. untersuchten die Synthese und Oberflächenaktivität von chiralen N-Palmitoyl-AAs basierend auf Methionin, Prolin, Leucin, Threonin, Phenylalanin und Phenylglycin in einem cyclischen/racemischen Gemisch. Pang und Chu beschrieben die Synthese von Monomeren auf Aminosäurebasis und Monomeren auf Dicarboxylsäurebasis in Lösung Eine Reihe von funktionellen und biologisch abbaubaren Polyamidester auf Aminosäurebasis wurden durch Co-Kondensationsreaktionen in Lösung synthetisiert.
Cantaeuzene und Guerreiro berichteten über die Veresterung von Carboxsäuregruppen von Boc-ala-oh und boc-asp-oh mit langkettigen aliphatischen Alkoholen und Diolen, mit Dichlormethan als Lösungsmittel und Agarose 4B (Sepharose 4B) als Katalysator. In dieser Studie lieferte die Reaktion von BOC-ALA-OH mit Fettalkoholen bis zu 16 Kohlenstoffe gute Ausbeuten (51%), während für BOC-ASP-OH 6 und 12 Kohlenstoffe mit einer entsprechenden Ausbeute von 63% besser waren [64]. 99,9%) in Ausbeuten im Bereich von 58%bis 76%, die durch die Bildung von Amidbindungen mit verschiedenen langkettigen Alkylaminen oder Esterbindungen mit Fettalkoholen durch CBZ-Arg-Os synthetisiert wurden, wobei Papain als Katalysator fungierte.
5.2.2 Synthese von Aminosäure/Peptid-Tensiden auf Gemini-Basis
Gemini-Tenside auf Aminosäurebasis bestehen aus zwei geraden AAS-Molekülen, die von einer Abstandsgruppe von Kopf an Kopf miteinander verbunden sind. Es gibt 2 mögliche Schemata für die chemoenzymatische Synthese von Tensiden auf Aminosäure-Basis (Abbildungen 6 und 7). In 6 werden 2 Aminosäurerivate mit der Verbindung als Spacer -Gruppe umgesetzt und dann 2 hydrophobe Gruppen eingeführt. In Abbildung 7 werden die 2 geraden Kettenstrukturen direkt durch eine bifunktionelle Abstandsabstandsgruppe miteinander verbunden.
Die früheste Entwicklung der enzymkatalysierten Synthese von Gemini-Lipoaminosäuren wurde von Valivety et al. Yoshimura et al. untersuchte die Synthese, Adsorption und Aggregation eines Gemini-Tensids auf Aminosäurerbasis basierend auf Cystin und N-Alkylbromid. Die synthetisierten Tenside wurden mit den entsprechenden monomeren Tensiden verglichen. Faustino et al. beschrieben die Synthese von monomeren AAS-basierten anion-basierten monomeren AAs auf Basis von L-Cystine, D-Cystin, DL-Cystin, L-Cystein, L-Methionin und L-Sulfoalanin und derene von Gemini mithilfe von Leitfähigkeit, Gleichgewichtsoberflächenspannung und stationärer Fluoreszenzenzarakterisierung von ihnen. Es wurde gezeigt, dass der CMC -Wert von Gemini durch Vergleich von Monomer und Gemini niedriger war.
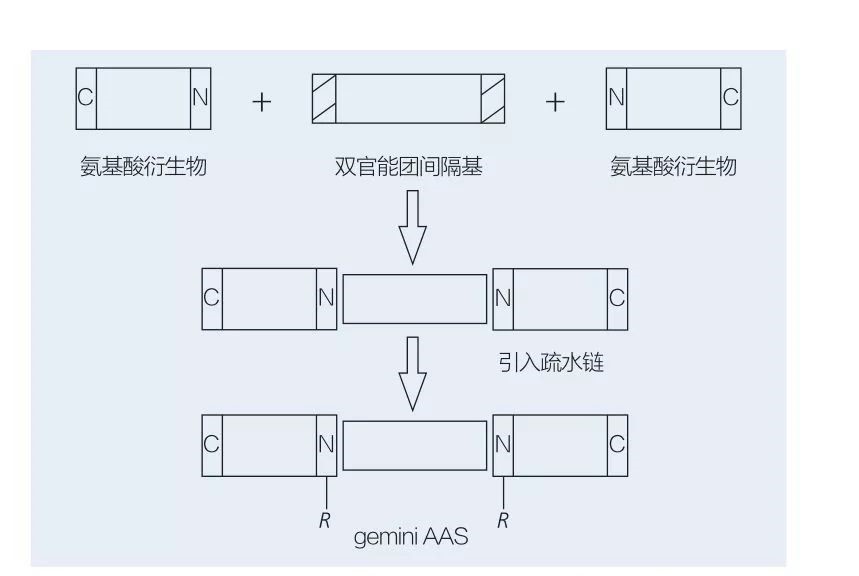
Abb.6 Synthese von Gemini AAS unter Verwendung von AA -Derivaten und Abstandshalter, gefolgt von der Insertion der hydrophoben Gruppe
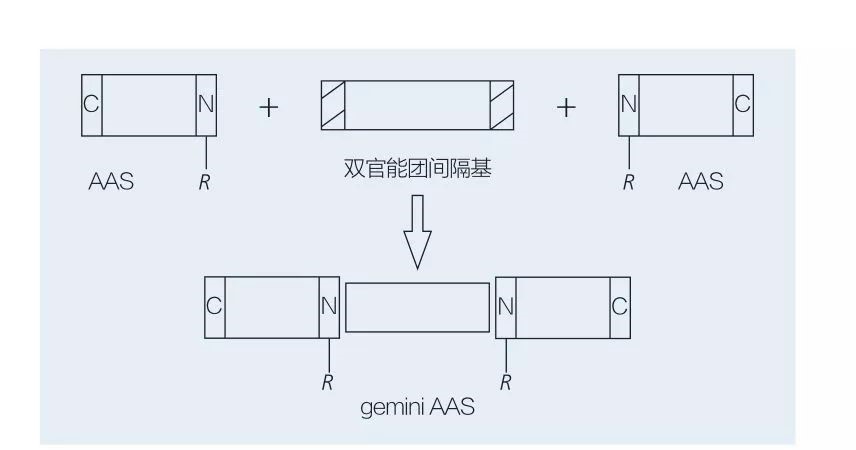
Abb.7 Synthese von Gemini Aass unter Verwendung bifunktionaler Abstandshalter und AAS
5.2.3 Synthese von Glycerolipid -Aminosäure/Peptid -Tensiden
Glycerolipid-Aminosäure/Peptid-Tenside sind eine neue Klasse von Lipidaminosäuren, die strukturelle Analoga von Glycerin-Mono- (oder di-) Estern und Phospholipiden sind, da ein oder zwei Fettketten mit einer Aminosäure verbunden sind, die mit dem Glycerin-Backbone verbunden ist. Die Synthese dieser Tenside beginnt mit der Herstellung von Glycerinestern von Aminosäuren bei erhöhten Temperaturen und in Gegenwart eines sauren Katalysators (z. B. BF 3). Die enzymkatalysierte Synthese (unter Verwendung von Hydrolasen, Proteasen und Lipasen als Katalysatoren) ist ebenfalls eine gute Option (Abbildung 8).
Die enzymkatalysierte Synthese von Dilaiylierten Arginin-Glyceridenkonjugaten unter Verwendung von Papain wurde berichtet. Es wurde auch über eine Synthese von Diacylglycerin -Ester -Konjugaten aus Acetylarginin und Bewertung ihrer physikalisch -chemischen Eigenschaften berichtet.
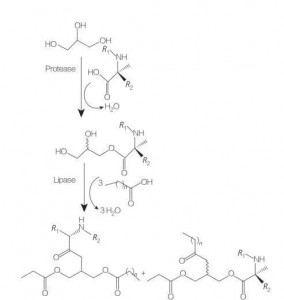
Abb.8 Synthese von Mono- und Diacylglycerol -Aminosäure -Konjugaten
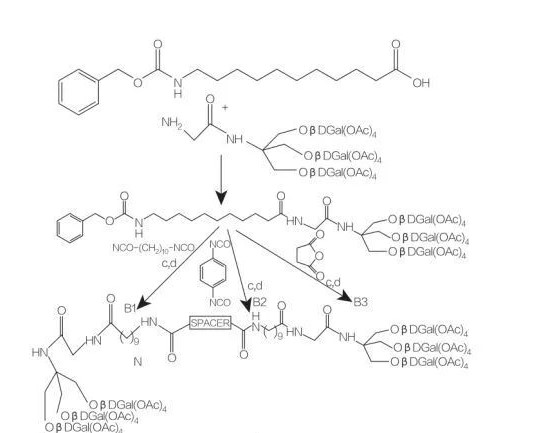
Spacer: NH- (Ch2)10-Nh: cincusb1
Spacer: NH-C6H4-Nh: compincessb2
Spacer: Ch2-Ch2: compincessb3
Abb.
5.2.4 Synthese von Aminosäure/Peptid-Tensiden auf Bola-basierter
Amphiphile auf Aminosäurebasis auf Bola-Typ enthalten 2 Aminosäuren, die mit derselben hydrophoben Kette verbunden sind. Franceschi et al. beschrieben die Synthese von Amphiphilen von Bola-Typen mit 2 Aminosäuren (D- oder L-Alanin oder L-Histidin) und 1 Alkylkette unterschiedlicher Längen und untersuchten ihre Oberflächenaktivität. Sie diskutieren die Synthese und Aggregation neuer Amphiphile vom Bola-Typ mit einer Aminosäurefraktion (unter Verwendung einer ungewöhnlichen β-Aminosäure oder einer Alkohol) und einer C12-C20-Abstandshaltergruppe. Die ungewöhnlichen β-Aminosäuren können ein Zuckeraminoacid, ein Azidothymin (AZT)-abgeleiteter Aminosäure, eine Norbornene-Aminosäure und ein von AZT stammender Aminoalkohol sein (Abbildung 9). Die Synthese von symmetrischen Bola-Typ-Amphiphilen, die aus TRIS (Hydroxymethyl) Aminomethan (Tris) abgeleitet sind (Abbildung 9).
06 Physikochemische Eigenschaften
Es ist bekannt, dass Tenside (AAS) auf Aminosäurebasis vielfältig und vielseitig in der Natur sind und in vielen Anwendungen eine gute Anwendbarkeit aufweisen, wie z.
Basierend auf den Tensideigenschaften von Aminosäuren (z. B. Oberflächenspannung, CMC, Phasenverhalten und Krafftemperatur) wurden die folgenden Schlussfolgerungen nach umfangreichen Studien gezogen - die Oberflächenaktivität von AAs ist der seines konventionellen Tensid -Gegenstücks überlegen.
6.1 Kritische Mizellenkonzentration (CMC)
Die kritische Mizellenkonzentration ist einer der wichtigen Parameter von Tensiden und regiert viele oberflächenaktive Eigenschaften wie Solubilisierung, Zelllyse und ihre Wechselwirkung mit Biofilmen usw., wobei im Allgemeinen die Kettenlänge des Kohlenwasserstoff -Schwanzes erhöht wird (erhöht die Hydrophobizität), die zu einer Verringerung des CMC -Werts der Surfaktanzlösung erhöht wird, somit die Oberfläche und somit erhöht und somit die Oberfläche erhöhen. Tenside, die auf Aminosäuren basieren, haben normalerweise niedrigere CMC -Werte im Vergleich zu herkömmlichen Tensiden.
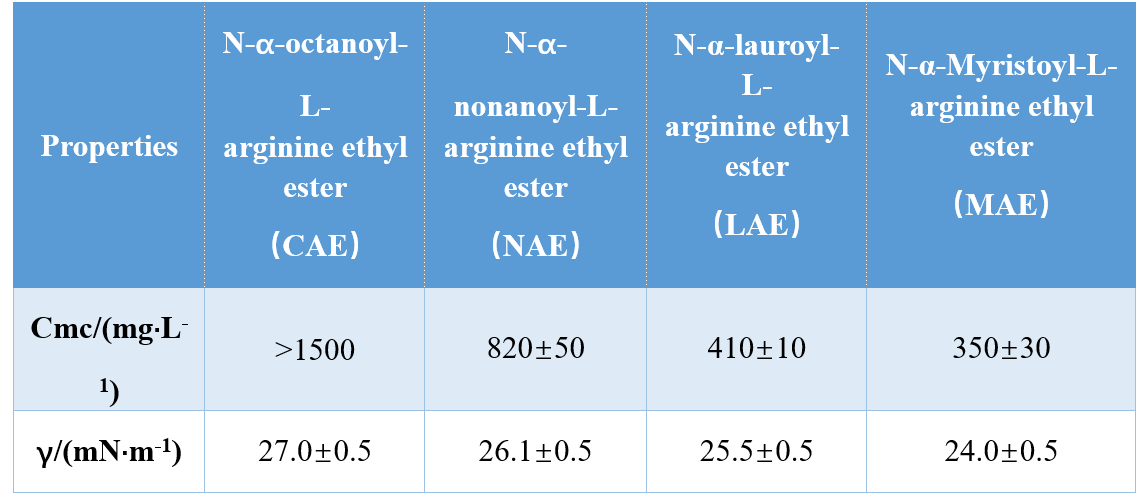
Durch verschiedene Kombinationen von Kopfgruppen und hydrophoben Schwänzen (mono-kationisches Amid, bi-kationisches Amid, bi-kationisches Amid-Basis-Ester) haben Infante et al. synthetisierten drei AAs auf Argininbasis und untersuchten ihre CMC und γCMC (Oberflächenspannung bei CMC), wobei die CMC- und γCMC-Werte mit zunehmender hydrophobe Schwanzlänge abnahmen. In einer anderen Studie stellten Singare und Mhatre fest, dass der CMC von N-α-Acylarginin-Tensiden mit zunehmender Anzahl hydrophober Schwanzkohlenstoffatome abnahm (Tabelle 1).
Yoshimura et al. Untersuchte die CMC von Cystein-abgeleiteten Gemini-Tensiden auf Aminosäurerbasis und zeigte, dass der CMC abnahm, wenn die Kohlenstoffkettenlänge in der hydrophoben Kette von 10 auf 12 erhöht wurde. Weitere Erhöhung der Kohlenstoffkettenlänge auf 14 führten zu einer Erhöhung des CMC, was bestätigte, dass langkettige Gemini-Surfaktants zu einer niedrigeren Tendenz zu aggregiertem Tendenz zu aggregiert wurden.
Faustino et al. berichteten über die Bildung gemischter Mizellen in wässrigen Lösungen anionischer Zwillinge auf der Grundlage von Cystin. Die Gemini -Tenside wurden auch mit den entsprechenden konventionellen monomeren Tensiden (C 8 Cys) verglichen. Es wurde berichtet, dass die CMC-Werte von Lipid-Oberwassermischungen niedriger sind als die von reiner Tensiden. Gemini-Tenside und 1,2-diheptanoyl-sn-glyceryl-3-phosphocholin, ein wasserlösliches, mizellenbildendes Phospholipid, hatten CMC im Millimolarniveau.
Shrestha und Aramaki untersuchten die Bildung von viskoelastischen, schmuddelähnlichen Mizellen in wässrigen Lösungen gemischter aminosäurebasierter anionisch-nonionischer Tenside in Abwesenheit von Beimischungssalzen. In dieser Studie wurde festgestellt, dass N-Dodecyl-Glutamat eine höhere Krafftemperatur aufweist; Wenn sie jedoch mit der grundlegenden Aminosäure-L-Lysin neutralisiert wurden, erzeugten sie Mizellen und die Lösung verhalten sich wie eine Newtonsche Flüssigkeit bei 25 ° C.
6.2 gute Wasserlöslichkeit
Die gute Wasserlöslichkeit von AAS ist auf das Vorhandensein zusätzlicher CO-NH-Bindungen zurückzuführen. Dies macht AAs biologisch abbaubarer und umweltfreundlicher als die entsprechenden konventionellen Tenside. Die Wasserlöslichkeit von N-Acyl-L-Glutaminsäure ist aufgrund ihrer 2 Carboxylgruppen sogar noch besser. Die Wasserlöslichkeit von CN (Ca) 2 ist ebenfalls gut, da es 2 ionische Arginingruppen in 1 Molekül gibt, was zu einer effektiveren Adsorption und Diffusion an der Zellgrenzfläche und sogar zu einer effektiven bakteriellen Hemmung bei niedrigeren Konzentrationen führt.
6.3 Krafftemperatur und Kraftspunkt
Kraftstemperatur kann als das spezifische Löslichkeitsverhalten von Tensiden verstanden werden, deren Löslichkeit stark über einer bestimmten Temperatur steigt. Ionische Tenside neigen dazu, feste Hydrate zu erzeugen, die aus dem Wasser ausfallen können. Bei einer bestimmten Temperatur (der sogenannten Kraftsemperatur) wird normalerweise ein dramatischer und diskontinuierlicher Anstieg der Löslichkeit von Tensiden beobachtet. Der Kraftspunkt eines ionischen Tensids ist seine Krafftemperatur bei CMC.
Diese Löslichkeitsmerkmale wird normalerweise für ionische Tenside beobachtet und kann wie folgt erklärt werden: Die Löslichkeit des freien Tensid -freien Monomers ist unter der Krafftemperatur begrenzt, bis der Kraftspunkt erreicht ist, wobei seine Löslichkeit aufgrund der Bildung von Mizellen allmählich zunimmt. Um eine vollständige Löslichkeit zu gewährleisten, ist es erforderlich, Tensidformulierungen bei Temperaturen über dem Kraftspunkt vorzubereiten.
Die Kraftstemperatur von AAS wurde untersucht und mit der von herkömmlichen synthetischen Tensiden verglichen. Shrestha und Aramaki untersuchten die Kraftstemperatur von AAs auf Argininbasis, dass die kritische Mizellenkonzentration die Aggregationsverhalten in Form von Vormicen über 2-5 × 10-6-Mol-L-1 aufwies. N-Hexadecanoyl-AAS und diskutierte die Beziehung zwischen ihrer Krafftemperatur und den Aminosäureresten.
In den Experimenten wurde festgestellt, dass die Krafftemperatur von N-Hexadecanoyl-AAS mit abnehmender Größe der Aminosäurereste (Phenylalanin eine Ausnahme) zunahm, während die Hitze der Löslichkeit (Wärmeaufnahme) mit abnehmender Größe von Aminosäureresten (mit Ausnahme von Glycin und Phenylalanin) zunahm. Es wurde der Schluss gezogen, dass sowohl in Alanin- als auch in Phenylalaninsystemen die DL-Wechselwirkung stärker ist als die LL-Wechselwirkung in der festen Form des N-Hexadecanoyl-AAS-Salzes.
Brito et al. bestimmte die Kraftstemperatur von drei Serien neuer Aminosäurerbasis, die Tenside unter Verwendung differentieller Scanning-Mikrokalorimetrie basieren, und fand heraus, dass das Ändern des Trifluoracetat-Ion-Ion-Ion-Ions zu einem signifikanten Anstieg der Krafftemperatur (ca. 6 ° C) von 47 ° C führte. Das Vorhandensein von CIS-Double-Bindungen und die in den langkettigen Serivaten vorhandene Ungesättigte führten zu einer signifikanten Abnahme der Krafftemperatur. Es wurde berichtet, dass N-Dodecyl-Glutamat eine höhere Kraftstemperatur aufweist. Eine Neutralisation mit der grundlegenden Aminosäure-L-Lysin führte jedoch zur Bildung von Mizellen in Lösung, die sich wie Newtonsche Flüssigkeiten bei 25 ° C verhielten.
6.4 Oberflächenspannung
Die Oberflächenspannung von Tensiden hängt mit der Kettenlänge des hydrophoben Teils zusammen. Zhang et al. bestimmte die Oberflächenspannung von Natriumkokoylglycinat durch Wilhelmy -Plattenmethode (25 ± 0,2) ° C und bestimmte den Oberflächenspannungswert bei CMC als 33 mn -m -1, cmc als 0,21 mmol -l -1. Yoshimura et al. bestimmte die Oberflächenspannung der Oberflächenspannung am 2c n cys-Aminosäurebasis von Oberflächenwirkstoffen auf 2c n Cysbasis. Es wurde festgestellt, dass die Oberflächenspannung bei CMC mit zunehmender Kettenlänge (bis n = 8) abnahm, während der Trend für Tenside mit n = 12 oder länger Kettenlängen umgekehrt war.
Die Wirkung von CAC1 2 auf die Oberflächenspannung von Tensiden auf Dicarboxylated Aminosäure auf der Basis von Aminosäuren wurde ebenfalls untersucht. In diesen Studien wurde CAC1 2 zu wässrigen Lösungen von drei Dicarboxylierten-Aminosäure-Tensiden (C12 MALNA 2, C12 ASPNA 2 und C12 Gluna 2) gegeben. Die Plateau -Werte nach CMC wurden verglichen und es wurde festgestellt, dass die Oberflächenspannung bei sehr niedrigen CAC1 -2 -Konzentrationen abnahm. Dies ist auf die Auswirkung von Kalziumionen auf die Anordnung des Tensids an der Gaswasserschnittstelle zurückzuführen. Die Oberflächenspannungen der Salze von n-dodecylaminomalonat und n-dodecylaspartat hingegen waren ebenfalls bis zu 10 mmol-1-CAC1 2-Konzentration fast konstant. Über 10 mmol -l -1 steigt die Oberflächenspannung aufgrund der Bildung einer Ausfällung des Kalziumsalzes des Tensids stark an. Für das Dinatriumsalz von N-Dodecyl-Glutamat führte eine mäßige Zugabe von CAC1 2 zu einer signifikanten Abnahme der Oberflächenspannung, während eine anhaltende Zunahme der CAC1 2-Konzentration keine signifikanten Veränderungen mehr verursachte.
Um die Adsorptionskinetik der AAS-Typen-Typen an der Gaswassergrenzfläche zu bestimmen, wurde die dynamische Oberflächenspannung unter Verwendung der maximalen Blasendruckmethode bestimmt. Die Ergebnisse zeigten, dass für die längste Testzeit die dynamische Oberflächenspannung von 2C 12 nicht änderte. Die Abnahme der dynamischen Oberflächenspannung hängt nur von der Konzentration, der Länge der hydrophoben Schwänze und der Anzahl der hydrophoben Schwänze ab. Die zunehmende Konzentration des Tensids, die abnehmende Kettenlänge sowie die Anzahl der Ketten führten zu einem schnellen Zerfall. Die Ergebnisse, die für höhere Konzentrationen von C n Cys (n = 8 bis 12) erhalten wurden, wurde als sehr nahe an der nach der Wilhelmy -Methode gemessenen γ -CMC festgestellt.
In einer anderen Studie wurden die dynamischen Oberflächenspannungen von Natrium -Dilaylyl -Cystin (SDLC) und Natrium -Didecamino -Cystin durch die Wilhelmy -Plattenmethode bestimmt, und zusätzlich wurden die Gleichgewichtsoberflächenspannungen ihrer wässrigen Lösungen durch das Abfallvolumenmethode bestimmt. Die Reaktion von Disulfidbindungen wurde auch mit anderen Methoden weiter untersucht. Die Zugabe von Mercaptoethanol zu 0,1 mmol -l -1SDLC -Lösung führte zu einem raschen Anstieg der Oberflächenspannung von 34 mn -m -1 bis 53 mn -m -1. Da NaClo die Disulfidbindungen von SDLC zu Sulfonsäuregruppen oxidieren kann, wurden keine Aggregate beobachtet, wenn NaClo (5 mmol -l -1) zu der 0,1 mmol -1 -SDLC -Lösung zugesetzt wurde. Die Ergebnisse der Transmissionselektronenmikroskopie und der dynamischen Lichtstreuungsergebnisse zeigten, dass in der Lösung keine Aggregate gebildet wurden. Es wurde festgestellt, dass die Oberflächenspannung von SDLC über einen Zeitraum von 20 Minuten von 34 mn -m -1 auf 60 mn -m -1 zunahm.
6.5 Binäre Oberflächenwechselwirkungen
In den Biowissenschaften haben eine Reihe von Gruppen die Schwingungseigenschaften von Gemischen von kationischen AAS (Diacylglycerin-Arginin-Basis-Tenside) und Phospholipiden an der Gaswassergrenzfläche untersucht und schließlich zu dem Schluss kommen, dass diese nicht ideale Eigenschaft zu einer Prävalenz elektrostatischer Wechselwirkungen führt.
6.6 Aggregationseigenschaften
Dynamische Lichtstreuung wird üblicherweise verwendet, um die Aggregationseigenschaften von Monomeren auf Aminosäurebasis und Gemini-Tensiden bei Konzentrationen über CMC zu bestimmen, was zu einem scheinbaren hydrodynamischen Durchmesser DH (= 2R H) führt. Die durch C N Cys und 2CN Cys gebildeten Aggregate sind relativ groß und haben im Vergleich zu anderen Tensiden eine breite Maßstabverteilung. Alle Tenside außer 2C 12 Cys bilden typischerweise Aggregate von etwa 10 nm. Mizellengrößen von Gemini -Tensiden sind signifikant größer als die ihrer monomeren Gegenstücke. Eine Erhöhung der Kohlenwasserstoffkettenlänge führt auch zu einer Erhöhung der Mizellengröße. Ohta et al. beschrieben die Aggregationseigenschaften von drei verschiedenen Stereoisomeren von N-Dodkylphenyl-Alanylphenyl-Alanin-Tetramethylammonium in wässriger Lösung und zeigten, dass die Diastereoisomere die gleiche kritische Aggregationskonzentration in wässriger Lösung haben. Iwahashi et al. investigated by circular dichroism, NMR and vapor pressure osmometry the The formation of chiral aggregates of N-dodecanoyl-L-glutamic acid, N-dodecanoyl-L-valine and their methyl esters in different solvents (such as tetrahydrofuran, acetonitrile, 1,4-dioxane and 1,2-dichloroethane) with rotational properties was investigated durch kreisförmige Dichroismus, NMR- und Dampfdruck -Osmometrie.
6.7 Grenzflächenadsorption
Die Grenzflächenadsorption von Tensiden auf Aminosäurerbasis und ihr Vergleich mit ihrem herkömmlichen Gegenstück ist auch eine der Forschungsrichtungen. Beispielsweise wurden die Grenzflächen -Adsorptionseigenschaften von Dodecylestern aromatischer Aminosäuren, die aus LET und LEP erhalten wurden, untersucht. Die Ergebnisse zeigten, dass LEP und LEP niedrigere Grenzflächenbereiche an der Gas-Flüssig-Grenzfläche bzw. an der Wasser-/Hexan-Grenzfläche zeigten.
Bordes et al. untersuchten das Lösungsverhalten und die Adsorption an der Gaswassergrenzfläche von drei dicarboxylierten Aminosäure-Tensiden, den Dinatriumsalzen von Dodecylglutamat, Dodecylaspartat und Aminomalonat (mit 3, 2 und 1 Kohlenstoffatomen zwischen den beiden Carboxylgruppen). Laut diesem Bericht war der CMC der dicarboxylierten Tenside 4-5-mal höher als das des Monocarboxylierten Dodecylglycinsalzes. Dies wird auf die Bildung von Wasserstoffbrückenbindungen zwischen den dicarboxylierten Tensiden und benachbarten Molekülen durch die Amidgruppen zurückgeführt.
6.8 Phasenverhalten
Isotrope diskontinuierliche kubische Phasen werden für Tenside in sehr hohen Konzentrationen beobachtet. Tensidmoleküle mit sehr großen Kopfgruppen bilden tendenziell Aggregate einer kleineren positiven Krümmung. Marques et al. untersuchten das Phasenverhalten der 12lys12/12ser- und 8lys8/16ser -Systeme (siehe Abbildung 10), und die Ergebnisse zeigten, dass das 12lys12/12ser -System eine Phasen -Trennungszone zwischen dem mizellaren und vesikulären Lösungsbereich aufweist, während das 8LYS8/16 -Ser -System das 8/16 -Phasen -Phasen -Absatz zwischen dem Michelar -Phasen und dem vetuusualen Absatz (ELOUBUTISCHE ANGRIGUM) (ELGUTUINGEGEBNETE VERSUCHTE ANGEBETT) (ELOGUTIONISCHE VERSUCHTE ANGEBETTETETE DREGEGEBUTTEN (ELGUTISCHE VERSUCHTE ANGEBUCHTE), zeigt das 8lys -Region und die Elektrikationstegie (leguierte Mikellar -Region). Region). Es ist zu beachten, dass für die Vesikelregion des 12lys12/12ser -Systems Vesikel immer mit Mizellen koexistieren, während der Vesikelbereich des 8lys8/16ser -Systems nur Vesikel hat.
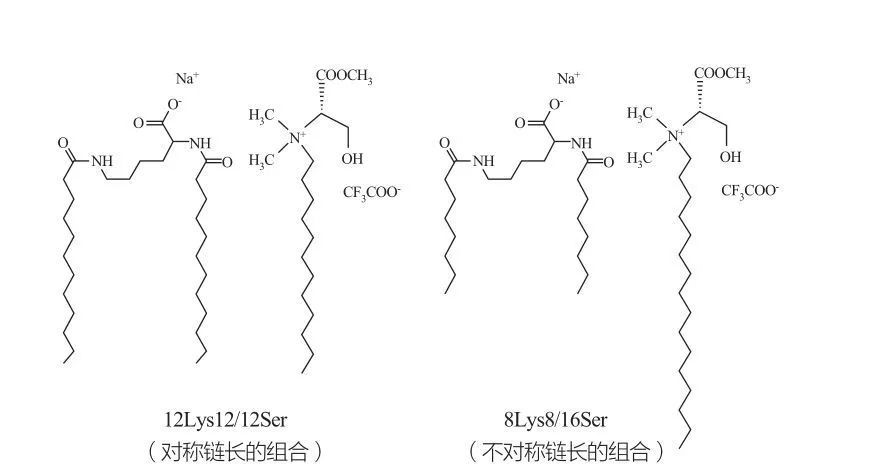
Katanonionsmischungen der Tenside auf Lysin- und Serinbasis: Symmetrisch 12lys12/12ser (links) und asymmetrisch 8lys8/16ser-Paar (rechts)
6.9 Emulgierung der Fähigkeit
Kouchi et al. untersuchte die emulgierende Fähigkeit, Grenzflächenspannung, Dispergierbarkeit und Viskosität von N- [3-Dodecyl-2-hydroxypropyl] -l-Arginin, L-Glutamat und anderen AAS. Im Vergleich zu synthetischen Tensiden (ihre konventionellen nichtionischen und amphoterischen Gegenstücke) zeigten die Ergebnisse, dass AAs eine stärkere Emulgierungsfähigkeit aufweisen als herkömmliche Tenside.
Baczko et al. synthetisierte neuartige anionische Aminosäure -Tenside und untersuchten ihre Eignung als chiralorientierte NMR -Spektroskopie -Lösungsmittel. Eine Reihe von amphiphilen L-PHE- oder L-ALA-Derivaten auf Sulfonatbasis mit unterschiedlichen hydrophoben Schwänzen (Pentyl ~ Tetredecyl) wurde durch Reaktion von Aminosäuren mit O-Sulfobenzo-Anhydrid synthetisiert. Wu et al. synthetisierte Natriumsalze von N-Fett-Acyl-AAs unduntersuchten ihre Emulgierungsfähigkeit in Öl-in-Wasser-Emulsionen, und die Ergebnisse zeigten, dass diese Tenside besser mit Ethylacetat als Ölphase als mit N-Hexan als Ölphase abschnitten.
6.10 Fortschritte in der Synthese und Produktion
Hartwasserwiderstand kann als die Fähigkeit von Tensiden verstanden werden, dem Vorhandensein von Ionen wie Kalzium und Magnesium in hartem Wasser zu widerstehen, dh die Fähigkeit, Niederschläge in Calciumseifen zu vermeiden. Tenside mit hoher harter Wasserbeständigkeit sind sehr nützlich für Waschmittelformulierungen und Körperpflegeprodukte. Hartwasserwiderstand kann bewertet werden, indem die Änderung der Löslichkeit und Oberflächenaktivität des Tensids in Gegenwart von Kalziumionen berechnet wird.
Eine andere Möglichkeit zur Bewertung der harten Wasserbeständigkeit besteht darin, den Prozentsatz oder die Gramm des Tensids zu berechnen, die für die Calciumseife erforderlich sind, die aus 100 g Natriumleat gebildet wird, um in Wasser dispergiert zu werden. In Bereichen mit hohem hartem Wasser können hohe Konzentrationen an Kalzium- und Magnesiumionen und Mineralgehalt einige praktische Anwendungen schwierig machen. Oft wird das Natriumion als Gegenion eines synthetischen anionischen Tensids verwendet. Da das zweizenteilige Kalziumionen an beide Tensidmoleküle gebunden ist, führt das Tensid leichter aus der Lösung, die die Wahrscheinlichkeit weniger durch die Lösung ausfällt.
Die Untersuchung der harten Wasserbeständigkeit von AAS zeigte, dass die Säure- und Hartwasserresistenz stark durch eine zusätzliche Carboxylgruppe beeinflusst wurde und die Säure- und Hartwasserwiderstand mit zunehmender Länge der Abstandshaltergruppe zwischen den beiden Carboxylgruppen weiter zunahm. Die Reihenfolge der Säure- und Hartwasserresistenz war C 12 Glycinat <C 12 Aspartat <C 12 Glutamat. Beim Vergleich der dicarboxylierten Amidbindung und des Dicarboxylatedamino -Tensids wurde festgestellt, dass der pH -Bereich des letzteren breiter war und seine Oberflächenaktivität durch Zugabe einer geeigneten Menge an Säure zunahm. Die dicarboxylierten N-Alkylaminosäuren zeigten in Gegenwart von Calciumionen eine Chelatwirkung, und C 12-Aspartat bildete weißes Gel. C 12 Glutamat zeigte eine hohe Oberflächenaktivität bei hoher Ca 2+ -Konzentration und wird voraussichtlich in der Meerwasserentsalzung eingesetzt.
6.11 Dispergierbarkeit
Dispergierbarkeit bezieht sich auf die Fähigkeit eines Tensids, die Koaleszenz und Sedimentation des Tensids in Lösung zu verhindern.Dispergierbarkeit ist eine wichtige Eigenschaft von Tensiden, die sie für Waschmittel, Kosmetika und Arzneimittel geeignet macht.Ein Dispersionsmittel muss eine Ester-, Ether-, Amid- oder Aminobindung zwischen der hydrophoben Gruppe und der terminalen hydrophilen Gruppe (oder zwischen den hydrophoben Gruppen der geraden Kette) enthalten.
Im Allgemeinen sind anionische Tenside wie Alkanolamido -Sulfate und amphoterische Tenside wie Amidosulfobetaine besonders wirksam als Dispergiermittel für Calciumseifen.
Viele Forschungsanstrengungen haben die Dispergierbarkeit von AAS ermittelt, bei denen festgestellt wurde, dass N-Lauroyl-Lysin nur schlecht mit Wasser kompatibel ist und für kosmetische Formulierungen schwer zu verwenden ist.In dieser Serie haben N-Acyl-substituierte grundlegende Aminosäuren eine hervorragende Dispergierbarkeit und werden in der Kosmetikindustrie verwendet, um die Formulierungen zu verbessern.
07 Toxizität
Konventionelle Tenside, insbesondere kationische Tenside, sind für Wasserorganismen sehr toxisch. Ihre akute Toxizität ist auf das Phänomen der Adsorption-Ionen-Wechselwirkung von Tensiden an der Zellwassergrenzfläche zurückzuführen. Die Verringerung des CMC von Tensiden führt normalerweise zu einer stärkeren Grenzflächenadsorption von Tensiden, was normalerweise zu einer erhöhten akuten Toxizität führt. Ein Anstieg der Länge der hydrophoben Kette von Tensiden führt auch zu einer Erhöhung der akuten Toxizität der Tensid.Die meisten AAs sind für den Menschen und die Umwelt (insbesondere für Meeresorganismen) niedrig oder ungiftig und sind für die Verwendung als Lebensmittelzutaten, Arzneimittel und Kosmetika geeignet.Viele Forscher haben gezeigt, dass Aminosäure-Tenside sanft und nicht in die Haut gerichtet sind. Tenside auf Argininbasis sind bekannt als weniger toxisch als ihre herkömmlichen Gegenstücke.
Brito et al. untersuchten die physikochemischen und toxikologischen Eigenschaften von Amphiphilen auf Aminosäurerbasis und deren [Derivate aus Tyrosin (Tyr), Hydroxyprolin (Hypen), Serin (SER) und Lysin (Lys)] Spontane Bildung von kationischen Vesikeln und gaben Daten über ihre akute toxische toxische toxische toxische toxische toxische toxische (ic 50). Sie synthetisierten kationische Vesikel aus Dodecyltrimethylammoniumbromid (DTAB)/Lys-Derivaten und/oder serkellosen-absenivativen Gemischen und testeten ihre Ökotoxizität und ihre hämolytische Potential, was zeigte, dass alle AAs und ihre vesikelhaltigen Mischungen weniger giftig als die konventionale DTAB-DTAB waren.
Rosa et al. untersuchte die Bindung (Assoziation) von DNA an stabile kationische Vesikel auf Aminosäure. Im Gegensatz zu herkömmlichen kationischen Tensiden, die häufig toxisch zu sein scheinen, scheint die Wechselwirkung kationischer Aminosäure-Tenside ungiftig zu sein. Die kationische AAS basiert auf Arginin, das spontan in Kombination mit bestimmten anionischen Tensiden stabile Vesikel bildet. Es wird auch berichtet, dass Korrosionsinhibitoren auf Aminosäurerbasis ungiftig sind. Diese Tenside sind leicht mit hoher Reinheit (bis zu 99%), kostengünstig, leicht biologisch abbaubar und in wässrigen Medien vollständig löslich zu synthetisieren. Mehrere Studien haben gezeigt, dass schwefelhaltige Aminosäure-Tenside in der Korrosionshemmung überlegen sind.
In einer kürzlich durchgeführten Studie haben Perinelli et al. berichtete über ein zufriedenstellendes toxikologisches Profil von Rhamnolipiden im Vergleich zu herkömmlichen Tensiden. Es ist bekannt, dass Rhamnolipide als Permeabilitätsverstärker fungieren. Sie berichteten auch über die Wirkung von Rhamnolipiden auf die epitheliale Permeabilität von makromolekularen Arzneimitteln.
08 antimikrobielle Aktivität
Die antimikrobielle Aktivität von Tensiden kann durch die minimale Hemmkonzentration bewertet werden. Die antimikrobielle Aktivität von Tensiden auf Argininbasis wurde ausführlich untersucht. Es wurde festgestellt, dass gramnegative Bakterien gegen Tenside auf Argininbasis resistenter sind als gegen grampositive Bakterien. Die antimikrobielle Aktivität von Tensiden wird normalerweise durch das Vorhandensein von Hydroxyl-, Cyclopropan- oder ungesättigten Bindungen innerhalb der Acylketten erhöht. Castillo et al. zeigten, dass die Länge der Acylketten und die positive Ladung den HLB-Wert (hydrophilisch-lipophiles Gleichgewicht) des Moleküls bestimmen, und diese wirken sich auf ihre Fähigkeit aus, Membranen zu stören. Nα-Acylarginin-Methylester ist eine weitere wichtige Klasse von kationischen Tensiden mit antimikrobieller Aktivität mit breitem Spektrum und ist leicht biologisch abbaubar und weist eine niedrige oder keine Toxizität auf. Studies on the interaction of Nα-acylarginine methyl ester-based surfactants with 1,2-dipalmitoyl-sn-propyltrioxyl-3-phosphorylcholine and 1,2-ditetradecanoyl-sn-propyltrioxyl-3-phosphorylcholine, model membranes, and with living organisms in the presence or absence of external barriers have shown that this class of surfactants Hat gut antimikrobiell die Ergebnisse zeigten, dass die Tenside eine gute antibakterielle Aktivität aufweisen.
09 Rheologische Eigenschaften
Die rheologischen Eigenschaften von Tensiden spielen eine sehr wichtige Rolle bei der Bestimmung und Vorhersage ihrer Anwendungen in verschiedenen Branchen, einschließlich Lebensmitteln, Pharmazeutika, Ölextraktion, Körperpflege und häuslichen Pflegeprodukten. Es wurden viele Studien durchgeführt, um die Beziehung zwischen der Viskoelastizität von Aminosäure -Tensiden und CMC zu diskutieren.
10 Anwendungen in der Kosmetikindustrie
AAs werden bei der Formulierung vieler Körperpflegeprodukte verwendet.Das Kalium-N-Kooylglycinat ist sanft auf der Haut und wird in der Gesichtsreinigung verwendet, um Schlamm und Make-up zu entfernen. N-Acyl-L-Glutaminsäure hat zwei Carboxylgruppen, was es wasserlöslicher macht. Unter diesen AAS werden AAs basierend auf C 12 -Fettsäuren in der Gesichtsreinigung häufig verwendet, um Schlamm und Make -up zu entfernen. AAs mit einer C-18-Kette werden als Emulgatoren in Hautpflegeprodukten verwendet, und es ist bekannt, dass N-Lauryl-Alaninsalze cremige Schäume erzeugen, die nicht für die Haut reizen und daher bei der Formulierung von Babypflegeprodukten verwendet werden können. In Zahnpasta verwendete AAs auf N-Laurylbasis weisen eine gute Wirksamkeit der Seife und der starken Enzym-inhibierenden Wirksamkeit auf.
In den letzten Jahrzehnten hat sich die Auswahl der Tenside für Kosmetika, Körperpflegeprodukte und Arzneimittel auf geringe Toxizität, Milde, Sanftmut für Berührung und Sicherheit konzentriert. Die Verbraucher dieser Produkte sind sich der möglichen Reizungen, Toxizität und Umweltfaktoren sehr bewusst.
Heute werden AAs verwendet, um viele Shampoos, Haarfarbstoffe und Badseifen zu formulieren, da sie gegenüber ihren traditionellen Kollegen in Kosmetik- und Körperpflegeprodukten viele Vorteile haben.Tenside auf Proteinbasis haben wünschenswerte Eigenschaften, die für Körperpflegeprodukte erforderlich sind. Einige AAs verfügen über filmbildende Fähigkeiten, während andere gute Schaumfunktionen haben.
Aminosäuren sind wichtig, die natürlich vorkommende feuchtigkeitsspendende Faktoren im Stratum Corneum. Wenn epidermale Zellen sterben, werden sie Teil des Stratum Corneum und die intrazellulären Proteine werden allmählich zu Aminosäuren abgebaut. Diese Aminosäuren werden dann weiter in das Stratum Corneum transportiert, wo sie Fett oder fettähnliche Substanzen in die epidermale Stratum Corneum aufnehmen, wodurch die Elastizität der Hautoberfläche verbessert wird. Ungefähr 50% des natürlichen Feuchtigkeitsfaktors in der Haut bestehen aus Aminosäuren und Pyrrolidon.
Kollagen, ein häufiger kosmetischer Bestandteil, enthält auch Aminosäuren, die die Haut weich halten.Hautprobleme wie Rauheit und Stumpf sind größtenteils auf einen Mangel an Aminosäuren zurückzuführen. Eine Studie zeigte, dass das Mischen einer Aminosäure mit einer Salbe -erleichterte Hautverbrennungen und die betroffenen Bereiche in ihren normalen Zustand zurückgekehrt waren, ohne Keloidnarben zu werden.
Es wurde auch festgestellt, dass Aminosäuren sehr nützlich sind, um beschädigte Nagelhaut zu sorgen.Trockenes, formloses Haar kann auf eine Abnahme der Konzentration von Aminosäuren in einem stark beschädigten Stratum Corneum hinweisen. Aminosäuren haben die Fähigkeit, in die Nagelhaut in den Haarschaft einzudringen und Feuchtigkeit von der Haut zu absorbieren.Diese Fähigkeit von Tensiden auf Aminosäurerbasis macht sie in Shampoos, Haarfarbstoffen, Haarweichmachern, Haarkonditionierern sehr nützlich und das Vorhandensein von Aminosäuren macht das Haar stark.
11 Anwendungen in alltäglichen Kosmetika
Derzeit besteht weltweit eine wachsende Nachfrage nach Waschmittelformulierungen auf Aminosäurerbasis.Es ist bekannt, dass AAs eine bessere Reinigungsfähigkeit, Schaumfähigkeit und Stoffweicheigenschaften aufweisen, was sie für Haushaltsrückleiter, Shampoos, Körperwaschmittel und andere Anwendungen geeignet macht.Es wird berichtet, dass eine von Asparedsäure abgeleitete amphoterische AAs ein hochwirksamer Waschmittel mit Chelateigenschaften ist. Die Verwendung von Waschmittelbestandteilen, die aus N-Alkyl-β-Aminoethoxysäuren bestehen, reduzierte die Hautreizungen. Es wurde berichtet, dass eine aus N-Kooyl-β-Aminopropionat bestehende flüssige Reinigungsmittelformulierung ein wirksames Reinigungsmittel für Ölflecken auf Metalloberflächen ist. Es wurde auch gezeigt, dass ein Aminocarbonsäure-Tensid, C 14 Chohch 2 NHCH 2 Coona, eine bessere Wäsche aufweist und zum Reinigen von Textilien, Teppichen, Haaren, Glas usw. verwendet wird. Die 2-Hydroxy-3-Aminopropions-Säure-N, N-Acetoacetoacetoacetoes-Derivate, die bekannte, dass es mit gut komplexen Fähigkeiten, und es gibt, dass die Fähigkeit zu schleichen, zu schleppen.
Die Herstellung von Waschmittelformulierungen auf der Basis von N- (N'-Long-Ketten-Acyl-β-Alanyl) -β-Alanin wurde von Keigo und Tatsuya in ihrem Patent zur besseren Waschfähigkeit und Stabilität, leichtem Schaumbruch und gutem Stoffweichung berichtet. Kao entwickelte eine Waschmittelformulierung auf der Basis von N-Acyl-1-N-Hydroxy-β-Alanin und berichtete über eine geringe Hautreizung, eine hohe Wasserbeständigkeit und eine hohe Fleckenentfernungsleistung.
Das japanische Unternehmen Ajinomoto verwendet niedrigtypische und leicht abbaubare AAS, die auf L-Glutaminsäure, L-Arginin und L-Lysin als Hauptbestandteile in Shampoos, Waschmitteln und Kosmetika basieren (Abbildung 13). Es wurde auch über die Fähigkeit von Enzymadditiven in Waschmittelformulierungen zur Entfernung von Proteinverschmutzung berichtet. N-Acyl-AAs, die aus Glutaminsäure, Alanin, Methylglycin, Serin und Asparaginsäure abgeleitet wurden, wurden für ihre Verwendung als hervorragende Flüssigkeitswaschmittel in wässrigen Lösungen berichtet. Diese Tenside erhöhen selbst bei sehr niedrigen Temperaturen überhaupt nicht die Viskosität und können leicht aus dem Lagergefäß des Schaumgeräts übertragen werden, um homogene Schäume zu erhalten.
Postzeit: Jun-09-2022

